Cyaninfarbstoffe
Cyanine, die zu den Polymethin-Farbstoffen gehören, enthalten eine Folge von Methingruppen, über die die Ladung zweier Stickstoffatome delokalisiert ist:

Aufgrund ihrer Struktur zeichnen sich Cyanine durch herausragende Extinktionskoeffizienten aus, die 100.000 L⋅mol−1⋅cm−1 oft übersteigen. Durch Variation der Substituenten lassen sich die Eigenschaften des Chromophors wie Absorptionswellenlänge, Photostabilität oder Fluoreszenz beeinflussen. So können beispielsweise Absorptions- und Emissionswellenlängen mit der Länge der Polymethinkette verändert werden: Längere Cyanine weisen höhere Wellenlängen auf bis hinein in den Nahinfrarotbereich.
Eine Reihe von Cyaninfarbstoffen wird in der naturwissenschaftlichen Forschung eingesetzt. Einige Thiazol- und Oxazolfarbstoffe werden für die Färbung von DNA oder Proteinen verwendet (TOTO, YOYO, Stains All und andere). Die in den Biowissenschaften populärsten Cyaninfarbstoffe jedoch wurden von einer Gruppe der Carnegie-Mellon-Universität um Alan Waggoner in den frühen 1990er-Jahren vorgestellt. Es handelt sich dabei um Abwandlungen des Cyanins Indocyaningrün (ICG), das seit den 1970er-Jahren in der Angiographie Verwendung findet. Diese Fluorophore enthalten alle zwei Indolenin-Ringe, die die Polymethinkette flankieren. Sie zeichnen sich durch geringe unspezifische Bindung an Biomoleküle aus und weisen aufgrund der hohen Extinktionskoeffizienten und Quantenausbeuten eine helle Fluoreszenz auf. Nachdem diese Moleküle zunächst unter Patentschutz standen, sind sie nach Auslaufen der Patente inzwischen gemeinfrei und von Lumiprobe für Forschung und kommerzielle Nutzung in der Form unterschiedlicher reaktiver Derivate erhältlich, beispielsweise als NHS-Ester, Maleimide, Azide für Click-Chemie-Reaktionen und andere.
Es existieren zwei Varianten der Cyaninfarbstoffe: sulfonierte und nicht-sulfonierte. In vielen Anwendungen sind sie gleichermaßen nutzbar, weil ihre spektralen Eigenschaften nahezu identisch sind. Beide können für die Markierung von Biomolekülen wie DNA oder Proteinen eingesetzt werden. Der Unterschied liegt in ihrer Löslichkeit: Die sulfonierten Cyanine sind wasserlöslich und erfordern in wässriger Umgebung nicht den Zusatz organischer Hilfslösungsmittel. Sie neigen in Wasser weniger stark zur Aggregation. In bestimmten Fällen ist der Einsatz der einen oder anderen Variante vorzuziehen (siehe Absatz Sulfonierte vs. nicht-sulfonierte Cyanine).
Nicht-sulfonierte Cyanine
Erhältliche nicht-sulfonierte Cyanine umfassen Cy3, Cy3.5, Cy5, Cy5.5, Cy7 und Cy7.5. Dabei steht Cy® für Cyanin und die erste Ziffer bezeichnet die Anzahl der Kohlenstoffatome zwischen den Indoleningruppen. Cy2, bei dem es sich anstelle eines Indolenins um ein Oxazolderivat handelt, stellt eine Ausnahme von dieser Regel dar. Das Suffix .5 wird bei Erweiterung um Benzolringe angehängt. Die Variation der Struktur erlaubt es, die spektralen Eigenschaften zu verändern und so mit einer Serie von Molekülen den wichtigsten Teil des sichtbaren und NIR-Spektrums abzudecken.

Die meisten Derivate der nicht-sulfonierten Cyanine (mit Ausnahme der Hydrochloride der Hydrazide und Amine) sind schlecht wasserlöslich. Beim Einsatz dieser Moleküle zum Markieren von Biomolekülen ist der Zusatz eines organischen Hilfslösungsmittels (5–20 % DMF oder DMSO) nötig, um eine effiziente Reaktion zu gewährleisten. Der Cyaninfarbstoff sollte zunächst im organischen Lösungsmittel aufgelöst werden, bevor er zur Lösung des Biomoleküls (Protein, Peptid, Aminogruppen tragende DNA) in einem geeigneten wässrigen Puffer zugegeben wird. Bei effizienter Konjugation reagiert der Farbstoff, bevor er ausfällt.
Die Fluoreszenzeigenschaften nicht-sulfonierter Cyanine sind kaum vom Lösungsmittel und ihrer Umgebung abhängig. Im Folgenden sind die Absorptions- und Emissionsspektren der nicht-sulfonierten Cyanine abgebildet:

Sulfonierte Cyanine
Sulfonierte Cyanine tragen zusätzliche Sulfonsäurereste, die das Lösen der Farbstoffmoleküle in wässrigen Phasen ermöglichen. Die geladenen Sulfonsäurereste reduzieren die Aggregationsneigung der Farbstoffmoleküle sowie vielfach markierter Konjugate.
Die derzeit erhältlichen sulfonierten Cyanine umfassen Sulfo-Cyanin 3, Sulfo-Cyanin 5 und Sulfo-Cyanin 7.

Sulfonierte Cyanine sind gut wasserlöslich, sodass für die Markierung mit diesen Reagenzien keine organischen Hilfslösungsmittel erforderlich sind.
Sulfonierte vs. nicht-sulfonierte Cyanine
Sulfonierte und nicht-sulfonierte Cyanine unterscheiden sich kaum in ihren spektralen Eigenschaften. Es existieren aber Unterschiede in der Markierungsanleitung, die man beachten sollte. Nicht-sulfonierte Cyanine müssen zunächst in organischen Lösungsmitteln (DMF oder DMSO) aufgelöst werden, bevor sie zur wässrigen Lösung des Zielmoleküls zugegeben werden. Der empfohlene Anteil an organischem Hilfslösungsmittel beträgt 10 % für die Cyanine 3, 5 und 7 und 15 % für ihre .5-Pendants. Die Sulfo-Cyanine können dagegen in rein wässrigen Lösungen eingesetzt werden. Darüber hinaus sollte man bei der Aufreinigung Folgendes beachten: Wenn die Produktreinigung durch Dialyse gegen Wasser oder wässrigen Puffer erfolgen soll, müssen sulfonierte Cyanine eingesetzt werden, um die Abtrennung freier Farbstoffmoleküle zu erreichen. Die Aufreinigung von Reaktionsgemischen mit sulfonierten oder nicht-sulfonierten Cyaninen kann mittels Gelfiltration, Chromatographie (HPLC, FPLC, Ionenaustausch) oder Elektrophorese erfolgen.

Sulfonierte und nicht-sulfonierte Cyanine sind beim Markieren vieler Molekülarten gleichermaßen einsetzbar:
- lösliche Proteine, die die Zugabe organischer Hilfslösungmittel tolerieren
- Antikörper (verwenden Sie 5–10 % DMF oder DMSO)
- DNA und Oligonukleotide
- Peptide
- viele niedermolekulare Substanzen
Konjugate, die mit vergleichbaren sulfonierten bzw. nicht-sulfonierten Fluorophoren erzeugt wurden (beispielsweise Cy5 vs. Sulfo-Cy5), unterscheiden sich kaum in ihren Fluoreszenzeigenschaften.
Sulfonierte Cyanine müssen eingesetzt werden bei:
- empfindlichen Proteinen, die durch DMF or DMSO denaturiert werden
- Markierung von Proteinen, wenn die Aufreinigung mittels Dialyse erfolgen soll
- Nanopartikeln in wässriger Lösung
- unlöslichen oder hydrophoben Proteinen
Nicht-sulfonierte Cyanine müssen eingesetzt werden bei:
- Reaktionen in organischen Lösungsmitteln (Dichlormethan, Acetonitril)
Folgende Cyanin-Reagenzien sind von Lumiprobe erhältlich:
| Fluorophor | Reaktive Gruppe |
|---|---|
| Sulfo-Cyanin 3 |
NHS-Ester Maleimid Azid Alkin Carbonsäure |
| Sulfo-Cyanin 5 |
NHS-Ester Maleimid Azid Alkin Carbonsäure |
| Sulfo-Cyanin 7 |
NHS-Ester Azid Amin carboxylic acid |
| Cyanin 3 |
NHS-Ester Maleimid Azid Alkin Hydrazid Amin Carbonsäure |
| Cyanin 3.5 |
NHS-Ester Azid Carbonsäure |
| Cyanin 5 |
NHS-Ester Maleimid Azid Alkin Hydrazid Amin Carbonsäure |
| Cyanin 5.5 |
NHS-Ester Maleimid Azid Alkin Hydrazid Amin Carbonsäure |
| Cyanin 7 |
NHS-Ester Maleimid Azid Alkin Hydrazid Amin Carbonsäure |
| Cyanin 7.5 |
NHS-Ester Maleimid Azid Alkin Hydrazid Amin Carbonsäure |
Cy® ist ein eingetragenes Warenzeichen von GE Healthcare.




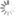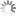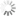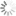
 $
$ 

